Mes: abril 2023
Articulos
El futuro de los antibióticos
Texto: Fernando Huecas, Beatriz Lavilla y Sara López Montesino
Con casi 1,27 millones de muertes anuales a nivel mundial en 2019 por infecciones causadas por bacterias multirresistentes, y 10 millones previstas para 2050, las autoridades sanitarias han elevado el nivel de alerta sobre esta crisis sanitaria. El rápido desarrollo y transmisión de los genes de resistencia entre bacterias patógenas del ser humano y de los animales, ha hecho que muchos expertos hablen ya de la próxima pandemia o, más bien, de una “pandemia silenciosa”.
Para hacer frente a este problema de salud global, que afecta tanto a la salud humana como animal y ambiental, se están desarrollando iniciativas desde diferentes perspectivas. La concienciación de ciudadanos y profesionales y las restricciones sobre el uso de los antimicrobianos disponibles, han sido sin duda las claves para promover el uso racional de estos medicamentos. Sin embargo, el estancamiento en la investigación y desarrollo de nuevas familias de antibióticos que llevamos viviendo desde la década de 1980, está teniendo sin duda un impacto negativo en nuestra lucha frente a las denominadas “superbacterias”, ya que cada vez contamos con menos armas para hacerles frente.
¿Cuál es la situación actual de la investigación en materia de antibióticos? ¿Qué fármacos en desarrollo tienen posibilidades de formar parte de nuestro arsenal en los próximos años? Echemos juntos un breve vistazo al futuro de los antibióticos.
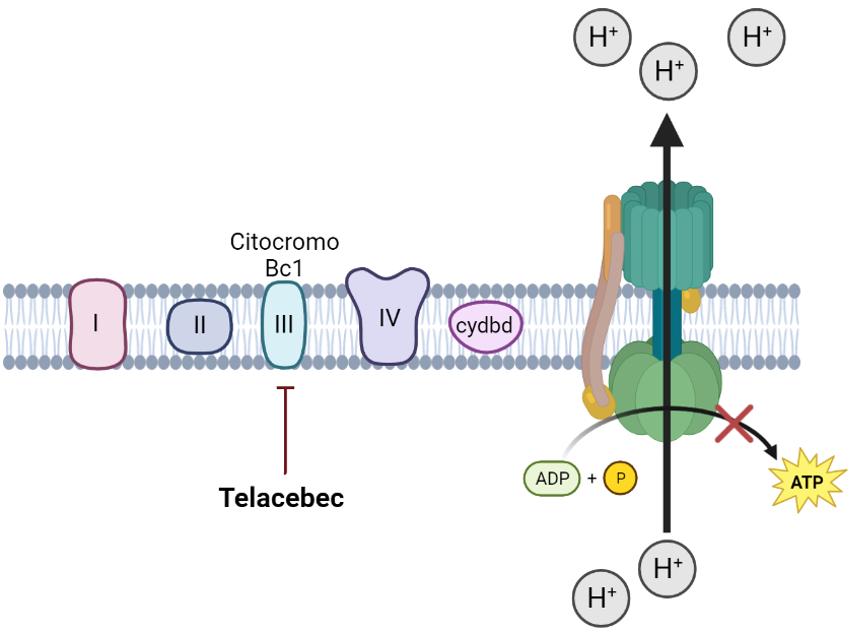
Telacebec
Este nuevo antituberculoso, potencialmente activo frente a cepas de Mycobacterium tuberculosis MDR (Multidrug-resistant) y XDR (Extensively drug-resistant), se encuentra actualmente en ensayos clínicos de fase II, donde está presentando buenos resultados en las variables utilizadas para evaluar su eficacia, como son el aumento en el tiempo de positivación del cultivo y una disminución de la carga bacteriana.
Su mecanismo de acción consiste en inhibir el complejo citocromo Bc1, una de las enzimas que este microorganismo utiliza para durante la respiración aeróbica para la obtención de energía en forma de ATP, lo que conlleva la muerte bacteriana.
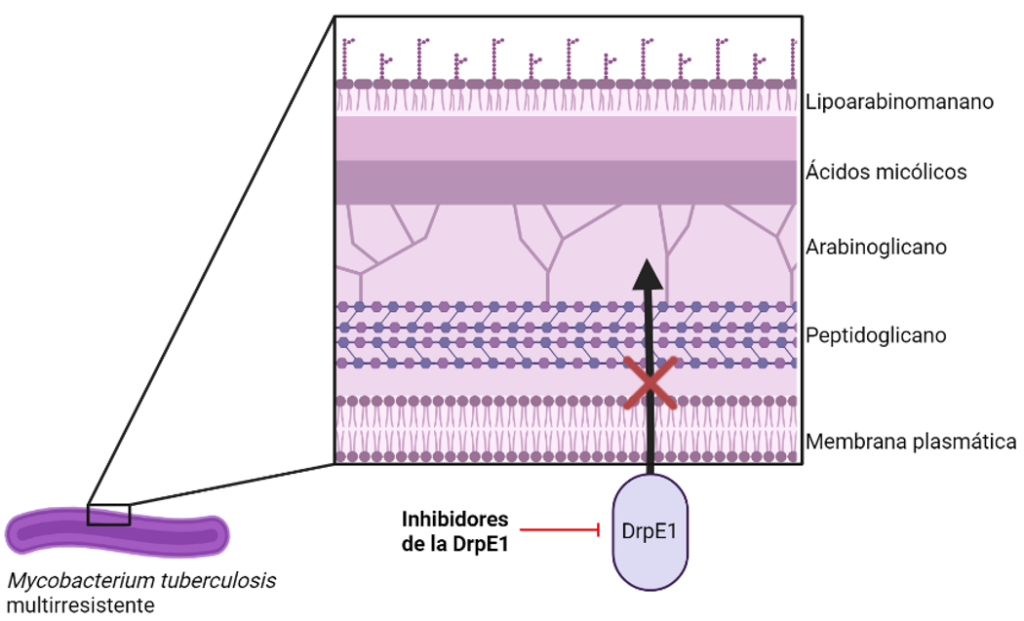
Inhibidores de la DprE1 (BTZ-043, Macozinona, TBA-7371 y OPC-167832)
Estos tres compuestos presentan actividad frente a Mycobacterium tuberculosis en estado de replicación activa al interrumpir la síntesis de su pared celular. Esto es debido a que producen una inhibición de la enzima DprE1, necesaria para la síntesis del DPX, precursor del arabinogalactano, un componente esencial para la formación de la pared celular de este tipo de microorganismos. Se encuentran actualmente en diferentes puntos de la fase II de ensayo clínico, y aunque su actividad de extiende a cepas MDR, debido a su propio mecanismo de acción no lo hace frente a formas en estado de latencia.
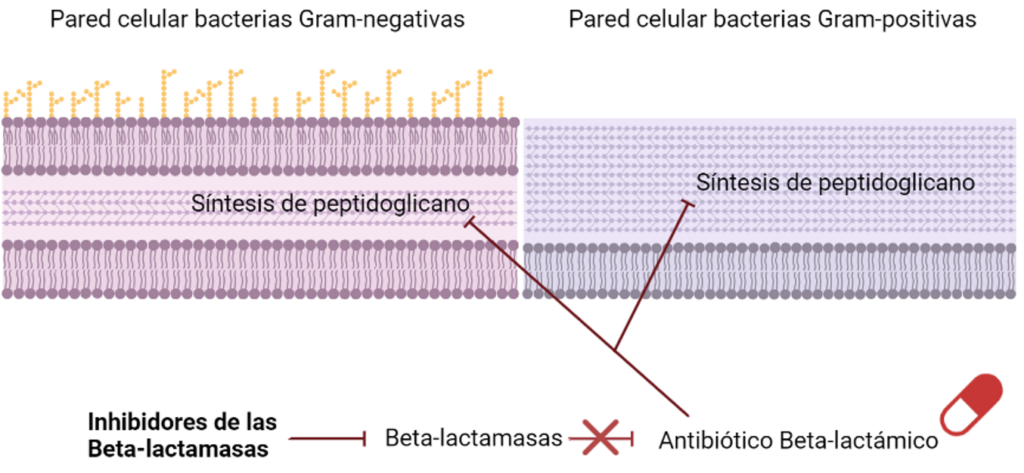
Taniborbactam
Uno de los mecanismos de resistencia más extendidos que las bacterias han desarrollado para evadir la acción de los antimicrobianos han sido las betalactamasas. Estas enzimas son capaces de degradar la estructura de los antibióticos betalactámicos haciendo que pierdan su actividad. Es por eso por lo que el tratamiento con este grupo de antibióticos suele ir acompañado de un segundo grupo de fármacos: los inhibidores de betalactamasas.
Uno de los inhibidores de betalactamasas en investigación más prometedores es el Taniborbactam, que ha mostrado actividad in vitro frente a todos los tipos y se encuentra actualmente en estudio frente a Pseudomonas aeruginosa y enterobacterias en combinación con cefepima, un tipo de antibiótico betalactámico del grupo de las cefalosporinas.
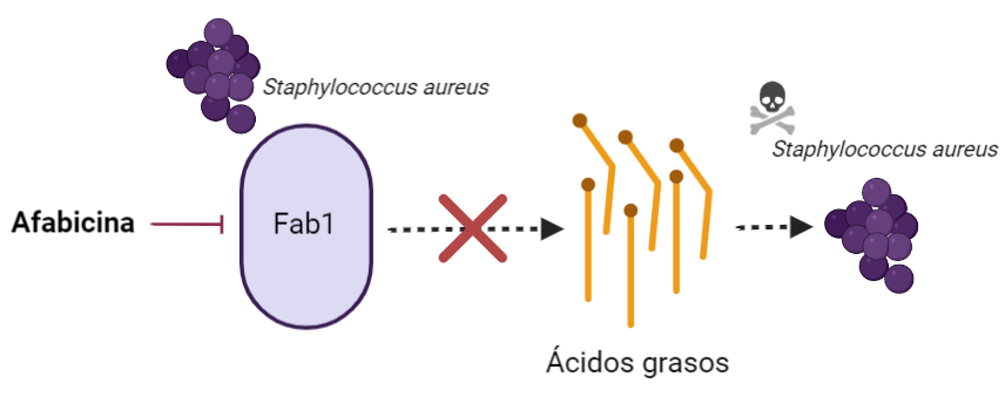
Afabicina
Este nuevo compuesto en investigación produce la inhibición el funcionamiento de FabI una enzima exclusiva de Staphylococcus spp. (incluyendo SARM, Staphylococcus aureus resistente a meticilina) que participa en la síntesis de ácidos grasos. Este compuesto es el primero de su clase debido a su novedoso mecanismo de acción, y se encuentra actualmente en fase II para infecciones osteoarticulares, habiendo finalizado un estudio en infecciones de piel y tejidos blandos.
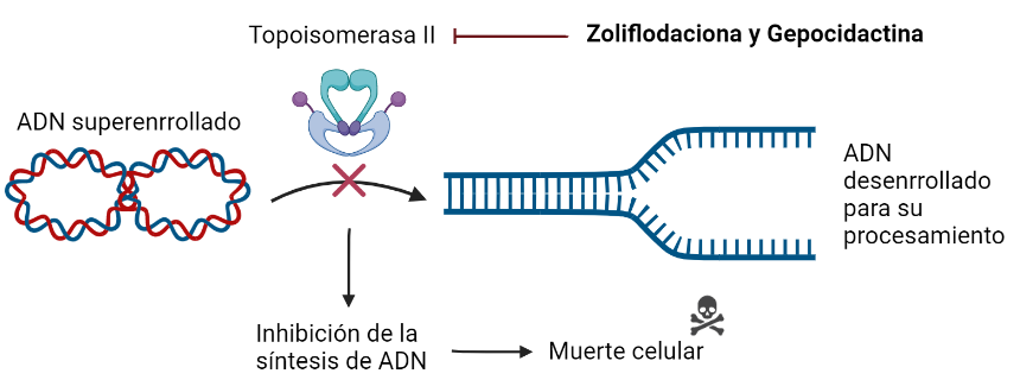
Zoliflodaciona y Gepocidactina
El mecanismo de acción de estos dos compuestos en investigación consiste en la inhibición de la topoisomerasa II (DNA girasa bacteriana), una enzima encargada de modificar la conformación del DNA para facilitar los procesos de replicación del material genético o de la síntesis de proteínas. La innovación en su estructura hace que su interacción con la DNA girasa sea diferente a la de los otros inhibidores de la misma clase, lo cual podría evitar resistencias cruzadas con los mismos. Esto podría permitir el tratamiento en conjunto con otras fluoroquinolonas.
Se encuentran actualmente comenzando los ensayos clínicos en fase III para el tratamiento de infecciones urinarias e infecciones causadas por Neisseria gonorrhoeae.
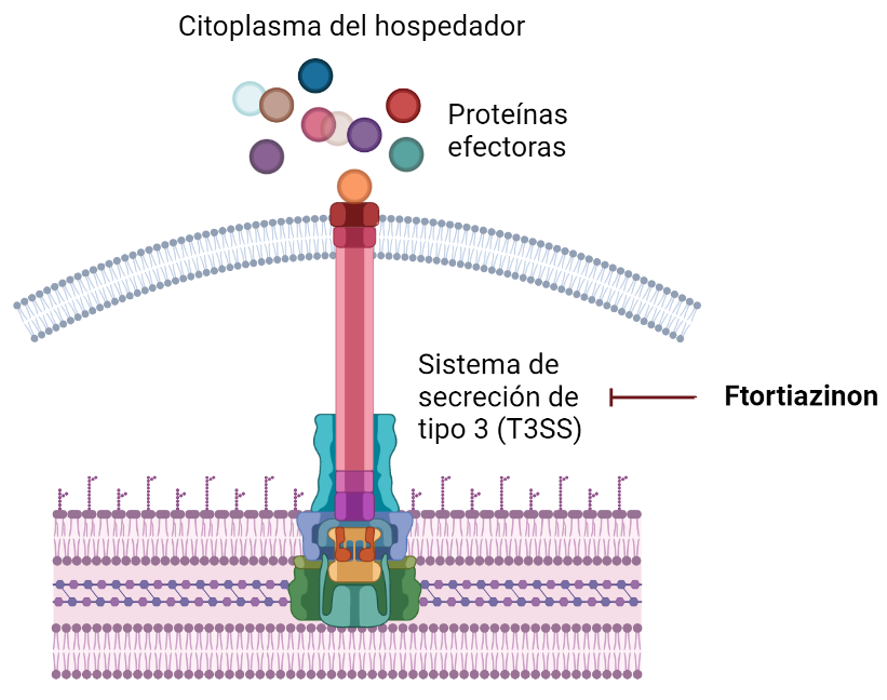
Ftortiazinon
Ensayado por el momento frente a cepas de Pseudomonas aeruginosa y Acinetobacter baumanii, este se trata de un inhibidor del sistema de secreción de tipo III (T3SS) bacteriano. Este sistema, también conocido como inyectisoma, es uno de los principales factores de virulencia de las bacterias Gramnegativas, ya que les permite “inyectar” toxinas a las células de los organismos a los que infecta.
Actualmente, se está evaluando en estudios clínicos de fase II en combinación con cefepima para infecciones del tracto urinario causadas por P. aeruginosa.
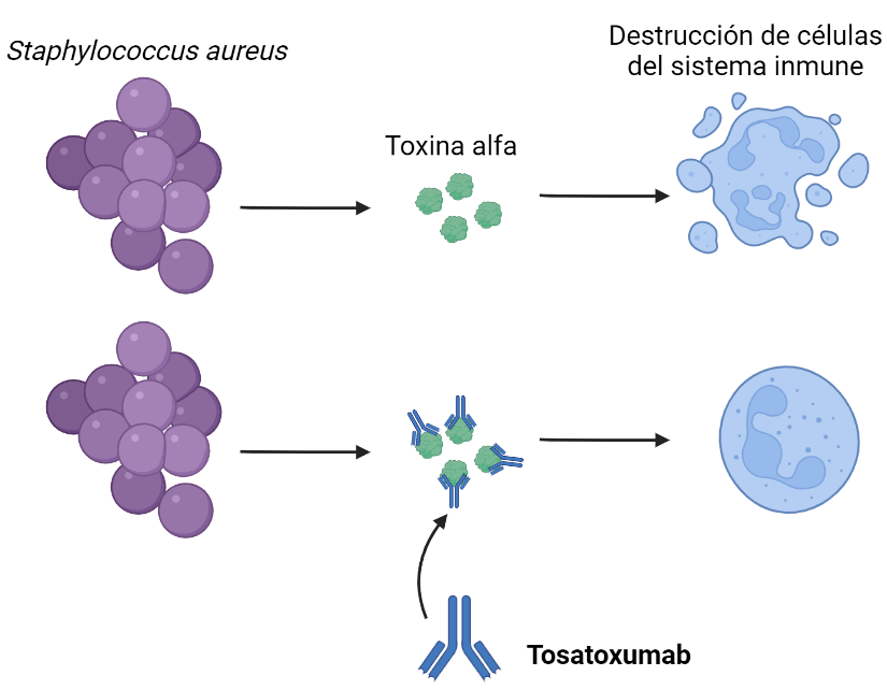
Tosatoxumab
Nos encontramos frente al primer anticuerpo monoclonal de la lista, una IgG1 dirigida frente a la toxina alfa de Staphylococcus aureus, que se encuentra actualmente comenzando la fase III para evaluar su eficacia como terapia adyuvante a la antibioterapia en neumonías causadas por esta bacteria.
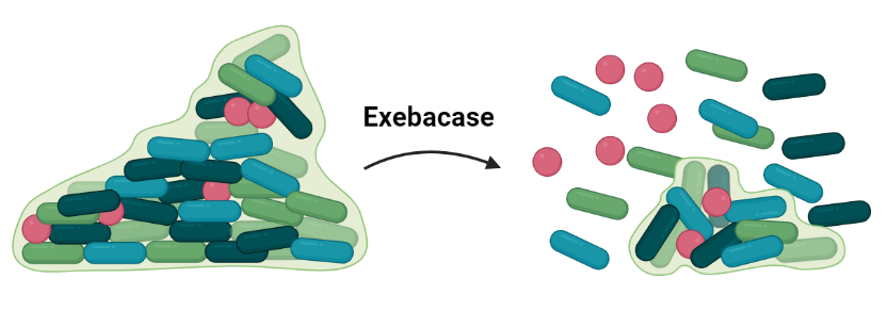
Exebacase
Se trata de una lisina con actividad bacteriolítica que puede degradar biofilms de Staphylococcus spp. al hidrolizar los enlaces que conforman su estructura. Los estudios en fase III se centran en su actividad frente a bacteriemias y endocarditis causadas por S. aureus, como apoyo a la terapia antibiótica establecida.
SER-109
Esta novedosa estrategia se basa en la utilización de esporas vivas de Firmicutes spp., purificadas a partir de las heces de donantes sanos. La capacidad de estas esporas para restaurar la microbiota de pacientes que han desarrollado colitis pseudomembranosa por Clostridioides difficile puede reducir el riesgo de recidivas al utilizarse como terapia adyuvante a la antibioterapia habitual (vancomicina/ fidaxomicina).
Los ensayos de fase III demuestran que los pacientes tratados con estas esporas desarrollan de nuevo la enfermedad producida por C. difficile con menor frecuencia que el grupo placebo.
Estos son algunos de los casi 80 antimicrobianos que se encuentran actualmente en la fase clínica de investigación. Sin embargo, esta cifra resulta insignificante en comparación con los compuestos en investigación para otras enfermedades, donde predominan los antineoplásicos con casi 9000 compuestos en investigación, seguido de los 1700 frente a condiciones psiquiátricas.
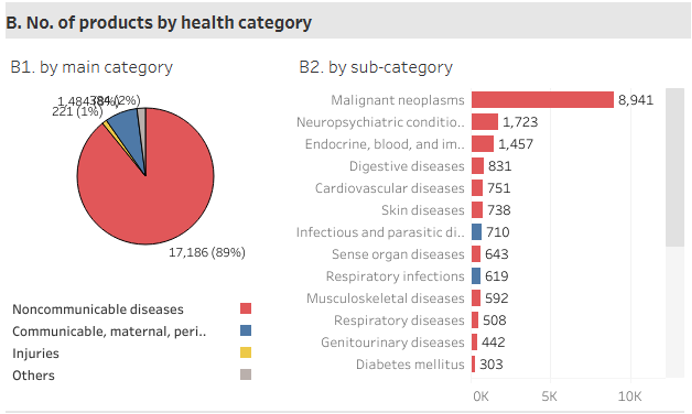
Aunque se están realizando esfuerzos muy prometedores, este panorama internacional corrobora la necesidad de fomentar la investigación de nuevos compuestos que nos puedan ayudar en la lucha frente a las superbacterias. Si trabajamos juntos #EsMisiónPosible.
Imagenes realizadas por los autores utilizando Biorender.

